Гліобластома – Перспективний підхід до лікування гліобластоми: поєднання фотодинамічної терапії та індукції некроптозу для покращення хірургічних і терапевтичних результатів
Автор: Назар Василів, 2024 – Накаукова работа – Targeting Glioblastoma: Inducing Necroptosis molecular pathway Post-Photodynamic Therapy for Enhanced Neurosurgical and Therapeutic Outcomes
Що таке гліобластома?
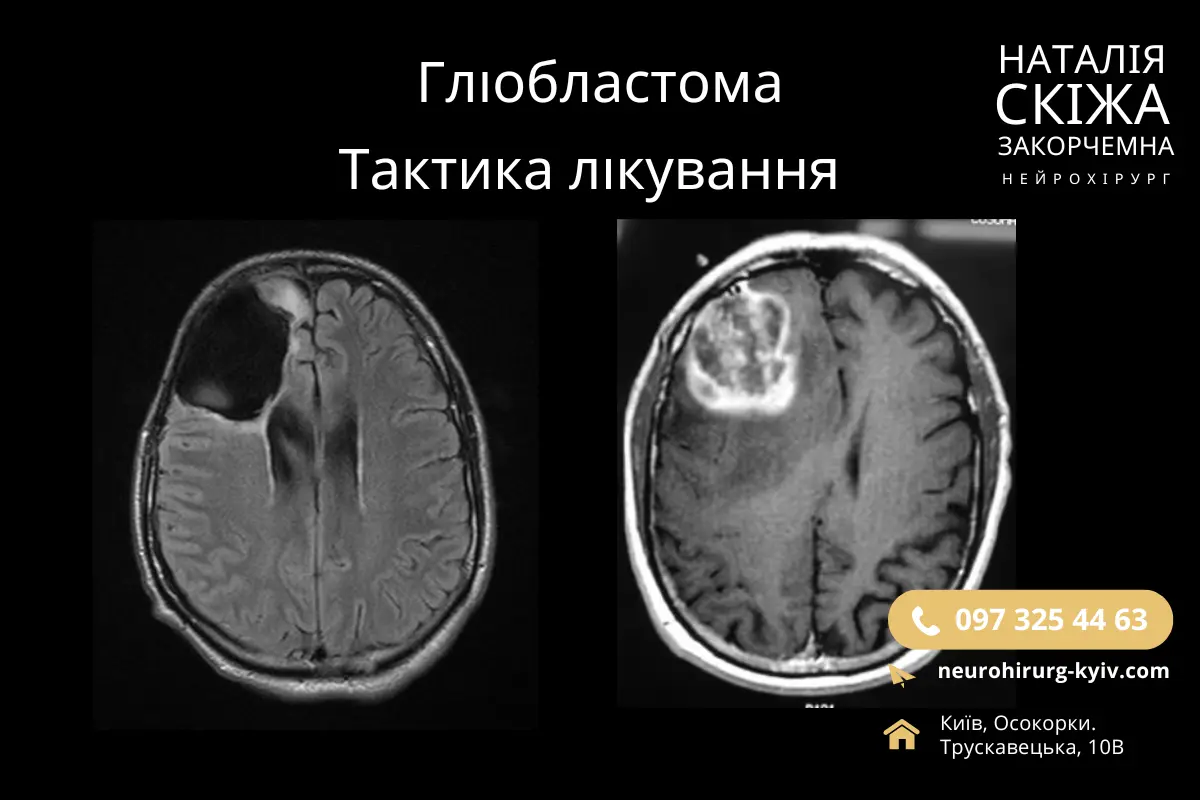
Гліобластома (ГБМ) це одна з найбільш агресивних форм злоякісних пухлин головного мозку у дорослих. З огляду на швидкий ріст, дифузне поширення у тканини мозку та стійкість до традиційних методів лікування, середній показник виживаності пацієнтів з ГБМ не перевищує 15 місяців.
Автор: Назар Василів, 2024 – Накаукова работа –
Традиційні методи, такі як хірургічне видалення, хіміотерапія та радіотерапія, часто виявляються недостатньо ефективними через інвазивність та гетерогенність клітинного складу пухлини. У цьому контексті дослідження Назаря Василіва пропонує інноваційний підхід, який полягає в поєднанні фотодинамічної терапії (ФДТ) з індукцією некроптозу, що забезпечує націлену загибель клітин гліобластоми з використанням некротичного механізму клітинної загибелі – некроптозу.
Лікування гліобластоми – Фотодинамічна терапія та її застосування
ФДТ базується на введенні фотосенсибілізаторів, таких як 5-амінолевулінова кислота (5-ALA), яка селективно накопичується в клітинах пухлини та перетворюється в протопорфірин IX (PpIX) – потужний фотосенсибілізатор. Після опромінення світлом певної довжини хвилі (наприклад, 635 нм), активований PpIX генерує реактивні форми кисню (ROS), які викликають окислювальний стрес і пошкодження клітинних структур пухлини.
Наукові коментарі: Традиційно вважалося, що ФДТ спричиняє апоптоз клітин, але останні дослідження, включно з роботами лікаря Василіва, показують, що ФДТ може також викликати некроптоз, особливо коли апоптоз блокується. Некроптоз є регульованим видом клітинної загибелі, що відрізняється від апоптозу вивільненням мембранних компонентів і запуском запального процесу, який може підвищити імуногенність пухлини, створюючи можливості для комбінованих імунотерапевтичних стратегій та доповнюю традиційну тактику лікування гліобластоми.
Індукція некроптозу як нова терапевтична стратегія
Некроптоз здійснюється через сигнальний каскад, що включає кінази RIPK1, RIPK3 та білок MLKL. Після фосфорилювання MLKL транслюється до плазматичної мембрани, де утворює пори, що призводить до розриву мембрани і загибелі клітини. Василів підкреслює, що цей вид клітинної загибелі особливо важливий для терапії ГБМ, де спостерігається стійкість до апоптозу, забезпечуючи альтернативний шлях для знищення пухлинних клітин.
Науковий коментар: Індукція некроптозу може мати двоякі переваги. По-перше, вона сприяє знищенню пухлинних клітин, стійких до апоптозу. По-друге, некроптоз є імуногенним видом клітинної загибелі, який може підвищити імунну відповідь організму на пухлину, що має велике значення для перспектив розробки імунотерапевтичних підходів у лікуванні гліобластоми.
Основні виклики хірургічного лікування та ФДТ при гліобластомі
Головна мета нейрохірургічного видалення ГБМ полягає в максимальному видаленні пухлини без пошкодження функціонально важливих структур мозку. Однак інфільтративна природа пухлини часто призводить до залишку мікроскопічного захворювання, що згодом спричиняє рецидив.
Нейрохірург за Англії Назар Василів зазначає, що ФДТ є ефективною для знищення залишків пухлини, однак обмежена глибиною проникнення, що не дозволяє охопити всі пухлинні клітини, особливо в глибших шарах тканини.
Науковий коментар: Обмеження глибини проникнення ФДТ (обумовлене дією світла лише на поверхневі шари тканини) є ключовою проблемою для застосування ФДТ у нейрохірургії. Комбінування ФДТ з некроптозом може подолати цю проблему, оскільки індукція некроптозу забезпечує загибель клітин, стійких до гіпоксії та поганої васкуляризації, які не піддаються впливу ФДТ.
Методологія дослідження
Василів використовував комбінований підхід для вивчення молекулярних шляхів ФДТ та індукції некроптозу:
- Клітинні культури: Стовбурові клітини гліобластоми (GSCs) підтримувались у середовищі DMEM/F12, збагаченому факторами росту та додатковими компонентами для підтримки стовбурових властивостей.
- Фотодинамічна терапія (ФДТ): ФДТ проводили за допомогою LED, що випромінювали світло довжиною хвилі 415 та 625 нм, забезпечуючи контрольовану експозицію для досягнення необхідної енергії опромінення.
- Аналіз життєздатності клітин: Оцінка життєздатності проводилась за допомогою SYTOX Green, який виявляє мертві клітини, та DAPI для загальної кількості клітин.
- Клоногенний аналіз: Після ФДТ клітини інкубували для утворення колоній протягом 10 днів, після чого проводився аналіз на виживаність клітин.
- Імуноблотинг: Використовувалися антитіла до ключових білків (Caspase-3, MLKL) для визначення специфічного шляху загибелі клітин, зокрема некроптозу.
Основні результати дослідження
- Селективність ФДТ у знищенні клітин Гліобластоми: ФДТ з 5-ALA викликала загибель стовбурових клітин гліобластоми, але не впливала на життєздатність здорових астроцитів, що підтверджувалося стабільним рівнем білка GFAP у клітинах мозку. Це підкреслює селективність ФДТ і можливість мінімізації побічних ефектів.
- Активація некроптозу після ФДТ: Високі рівні фосфорильованого MLKL у GSCs після ФДТ свідчать про активацію некроптозу як альтернативного шляху загибелі клітин. Інгібітори каспаз не змогли зупинити загибель клітин, що підтверджує некроптотичний шлях загибелі.
- Зниження колонігенної активності GSCs: Після ФДТ виживаність та здатність до утворення колоній у клітинах гліобластоми значно знижувались, що вказує на високий рівень цитотоксичності та зниження потенціалу пухлини до рецидиву.
Науковий коментар: Отримані результати мають велике значення, оскільки демонструють, що активація некроптозу дозволяє обійти захисні механізми стовбурових клітин пухлини. Це відкриває нові перспективи у розробці терапевтичних стратегій, які враховуватимуть індивідуальні молекулярні особливості пухлин.
Клінічні перспективи
Комбінація ФДТ з індукцією некроптозу має потенціал значно покращити результати лікування пацієнтів з гліобластомами, особливо тих, у кого пухлина стійка до апоптозу.
Такий підхід може дозволити досягти більш точного видалення пухлини при збереженні здорової тканини мозку. Більше того, можливість впливу некроптозу на імунну систему створює передумови для майбутнього поєднання з імунотерапевтичними агентами.
Дослідження Назаря Василіва представляє новаторський підхід до терапії гліобластоми, демонструючи важливість комбінованого застосування фотодинамічної терапії (ФДТ) та індукції некроптозу для досягнення більш високої ефективності протипухлинного впливу.
Поєднання ФДТ, що забезпечує селективне накопичення фотосенсибілізатора у клітинах пухлини та індукцію некроптозу як регульованого некротичного шляху загибелі клітин, відкриває перспективи для подолання резистентності гліобластоми до традиційних методів лікування.
ФДТ за допомогою 5-ALA активує фотосенсибілізатор протопорфірин IX, що викликає утворення реактивних форм кисню (ROS) і локалізоване пошкодження клітинних структур пухлини. Індукція некроптозу шляхом активації RIPK1, RIPK3 і MLKL забезпечує додатковий шлях цитотоксичної дії, який ефективно знищує клітини, стійкі до апоптозу, зокрема стовбурові клітини гліобластоми (GSC), що мають високий ризик рецидиву.
Некроптоз також викликає імуногенну відповідь, що підсилює вплив на пухлину та може сприяти імунотерапевтичному ефекту, залучаючи імунну систему до контролю залишкових пухлинних клітин.
Результати дослідження підкреслюють перспективність комбінаторних терапевтичних стратегій, зокрема тих, що інтегрують ФДТ з індукцією некроптозу, для підвищення специфічності та ефективності лікування ГБМ. Подальші клінічні дослідження повинні підтвердити безпеку та терапевтичну ефективність цього підходу, а також сприяти визначенню біомаркерів, що можуть прогнозувати чутливість до ФДТ-індукованого некроптозу.
Очікується, що ці результати закладуть основу для індивідуалізованих терапевтичних стратегій, що сприятимуть покращенню виживаності та якості життя пацієнтів з гліобластомою.
Автор: Назар Василів, 2024. Джерело: Vasyliv N. “Targeting Glioblastoma: Inducing Necroptosis molecular pathway Post-Photodynamic Therapy for Enhanced Neurosurgical and Therapeutic Outcomes.” MAR Neurology, Neurosurgery & Psychology (2024) 8:3.
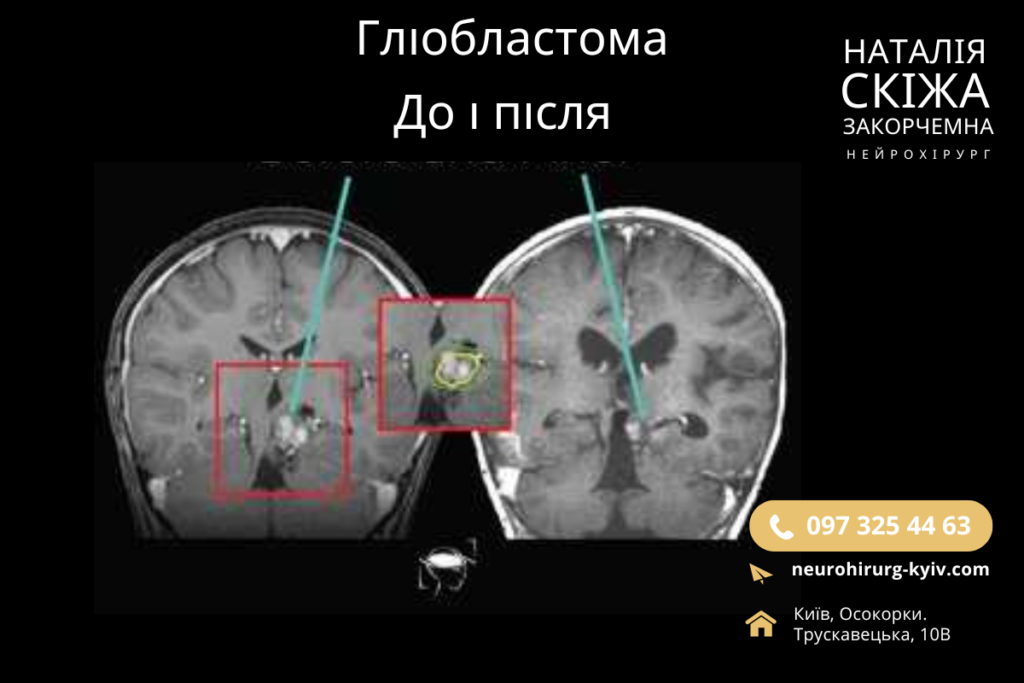
Методи діагностики гліобластоми
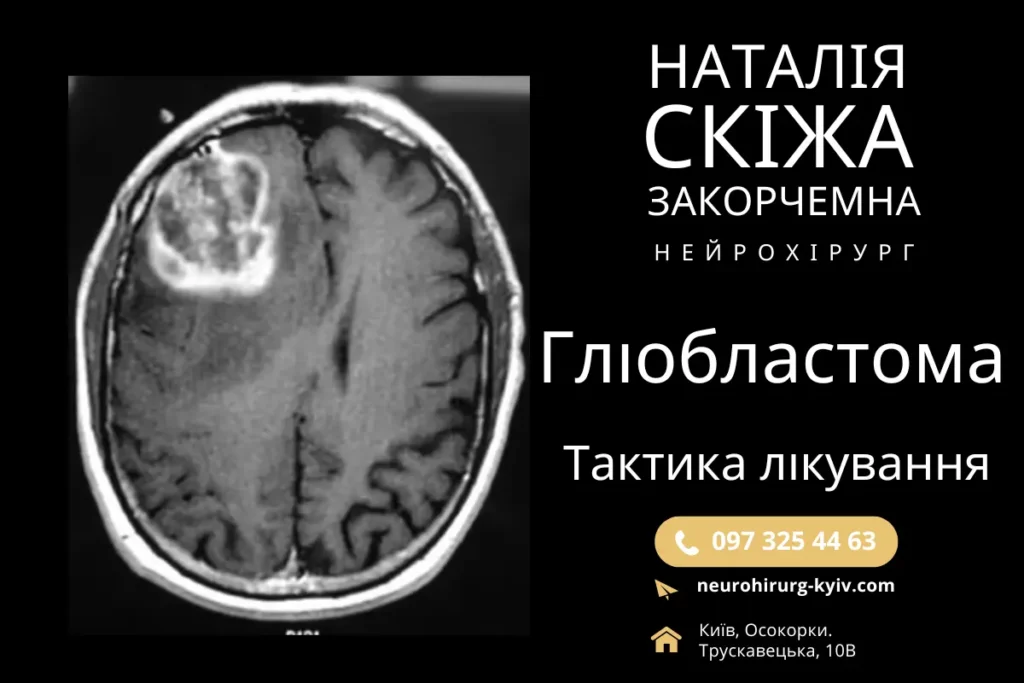
Діагностика гліобластоми базується на комплексному підході, який включає в себе клінічну, радіологічну та гістологічну оцінки. Основними методами діагностики є магнітно-резонансна томографія (МРТ головного мозку з контрастуванням), яка дозволяє визначити обсяг і розташування пухлини, а також виявити її інфільтративний характер.
При діагностиці МРТ гліобластома зазвичай проявляється як масивне новоутворення з нерівними краями, зони некрозу в центрі та яскравим підвищенням контрастності на периферії через неоангіогенез. Для більш детального розуміння метаболічних характеристик пухлини застосовується ПЕТ-КТ (позитронно-емісійна томографія) з радіомітками, що дозволяє оцінити рівень глюкозного метаболізму та активність пухлини.
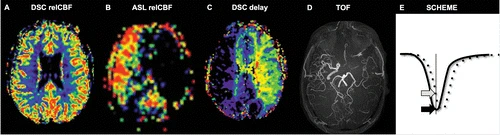
Підтвердження діагнозу здійснюється за допомогою біопсії пухлини з подальшим гістологічним та імуногістохімічним аналізом для виявлення маркерів, таких як IDH-мутації, MGMT-метилювання, статус мутації гена TP53 та інших, які допомагають оцінити прогноз і відповіді на терапію. Крім того, сучасні геномні та молекулярні методи, включаючи секвенування наступного покоління (NGS), дозволяють ідентифікувати індивідуальні генетичні та молекулярні особливості пухлини, що відкриває можливості для персоналізованих підходів до лікування гліобластоми.