Нові підходи до запобігання поширенню на центральну нервову систему при дифузній великоклітинній B-клітинній лімфомі
Значна кількість ретроспективних досліджень розглядала спірне питання застосування хіміотерапії для профілактики ураження центральної нервової системи (ЦНС) під час первинного лікування дифузної великоклітинної B-клітинної лімфоми (DLBCL).
Незважаючи на те, що поширення на ЦНС є грізним і часто смертельним ускладненням DLBCL, немає єдиної думки щодо того, які пацієнти повинні отримувати профілактику ЦНС і який метод є найефективнішим. Загальна частота рецидивів ЦНС серед усіх підгруп DLBCL становить приблизно 5%, але деякі клінічні фактори ризику, зокрема ураження певних анатомічних ділянок, пов’язані зі значно вищою частотою поширення на ЦНС.
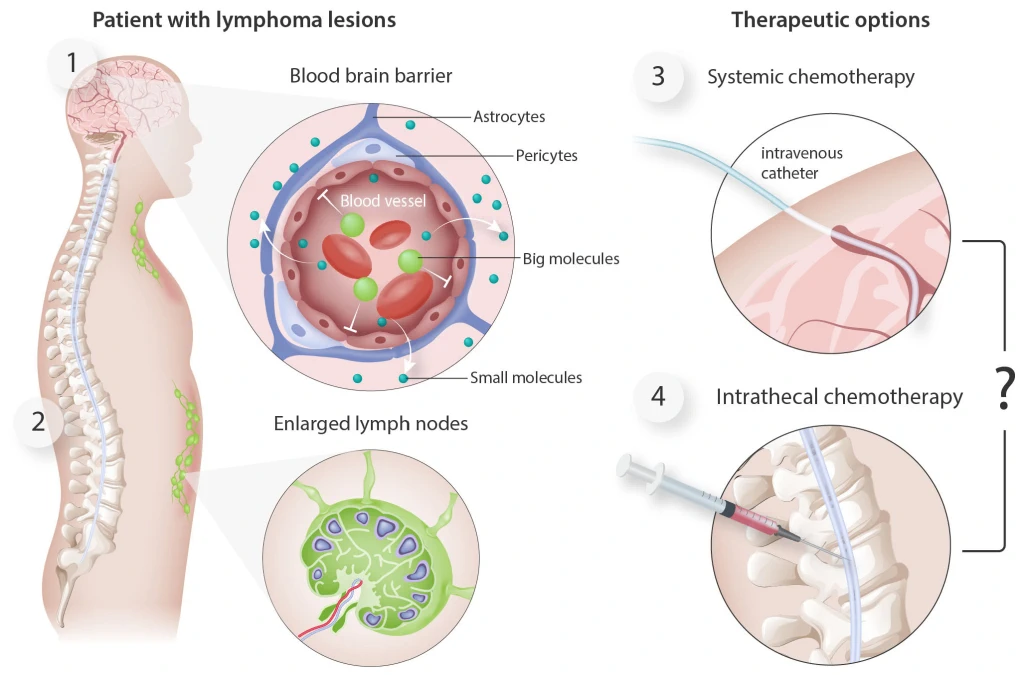
Більше того, зараз ми починаємо розкривати біологічну основу DLBCL із залученням ЦНС, оскільки певні генетичні підтипи демонструють внутрішньо вищий рівень тропізму до ЦНС. Міжнародний прогностичний індекс ЦНС (CNS-IPI) є загальновизнаною моделлю ризику, що стратифікує пацієнтів за категоріями ризику; поєднання цієї моделі з фенотипом походження клітин може покращити вибір пацієнтів.
Проте навіть найбільш надійні прогностичні моделі не можуть подолати фундаментальну проблему, що хіміотерапевтичні агенти, які є найбільш ефективними для лікування системного DLBCL, не проникають крізь гематоенцефалічний бар’єр. Навпаки, метотрексат, який надійно проникає в ЦНС, не є високоефективним для DLBCL. Найбільш поширеною профілактичною стратегією є повторні інтратекальні ін’єкції хіміотерапії, такі як метотрексат під час первинної терапії, але оскільки паренхіматозні ділянки мозку є найчастішими місцями рецидиву ЦНС, деякі експерти рекомендують використання препаратів із глибоким проникненням, таких як високі дози метотрексату.
Жодне рандомізоване проспективне дослідження не вирішило це конкретне питання безпосередньо, і як результат, практики лікування покладаються на консенсусні рекомендації та суттєво відрізняються між установами та окремими лікарями. По суті, дискусія щодо оптимальних методів доставки хіміотерапії є “гонкою до дна”, яка порівнює дві стратегії, що неадекватно вирішують клінічну проблему.
Хоча ретроспективні серії ефективні для генерації гіпотез або ідентифікації специфічних проблем, що вимагають подальшого вивчення, майже неможливо контролювати всі варіанти підходів до профілактики ЦНС, оскільки насправді не існує стандартного підходу. Найбільш надійні дані свідчать про те, що найпоширенішим підходом до профілактики ЦНС є повторні інтратекальні ін’єкції метотрексату або цитарабіну під час первинної терапії, тоді як лише значна меншість пацієнтів отримує високі дози метотрексату в середній дозі 3,5 г/м2 або під час первинної терапії, або відразу після її завершення. Важливо зазначити, що пацієнти, які отримують високі дози метотрексату, можуть також отримувати супутню інтратекальну хіміотерапію, що розмиває це довільне розмежування.
Однак, оскільки всі форми профілактики ЦНС мають клінічно значущі токсичності, це підкреслює той факт, що важливим обмеженням всіх доступних наборів даних є вибіркова упередженість. Нарешті, жодна форма профілактики ЦНС не є універсально ефективною, і частота рецидиву ЦНС у пацієнтів, які отримували профілактику, зазвичай становить близько 5% через 2-3 роки спостереження. З огляду на те, що рецидиви ЦНС можуть бути пізніми подіями, фактичне зниження ризику будь-якої форми профілактики ЦНС хіміотерапією, ймовірно, є щонайменше скромним, а нинішні стратегії можуть просто затримувати час рецидиву ЦНС.
Ризик залучення ЦНС нерівномірно розподілений серед усіх підгруп DLBCL, що може дозволити використання стратегій прецизійної медицини. Насправді, DLBCL не є єдиним захворюванням, а складається зі спектра агресивних лімфом зі значною генетичною різноманітністю. Поточна система класифікації визнає активовану B-клітинну DLBCL та B-клітинну DLBCL зародкового центру як окремі молекулярні підтипи і вводить новий різновид, лімфому високого ступеня, визначену наявністю перебудов MYC та BCL2 та/або BCL6.
Для покращення клінічних результатів необхідні нові терапії з доведеною ефективністю в межах генетично визначених підтипів. Кілька клінічних досліджень повідомляють про вражаючу клінічну активність інгібітора тирозинкінази Брютона (BTK) ібрутинібу та ібрутиніб-заснованих режимів при DLBCL з ураженням ЦНС, включаючи пацієнтів, які є рефрактерними до хіміотерапії.
Загалом, хіміотерапія як профілактика ЦНС не є універсально ефективною незалежно від методу доставки, і запобігання та лікування рецидивів ЦНС залишаються невирішеними клінічними потребами у лікуванні DLBCL. Проникнення через гематоенцефалічний бар’єр є важливим фактором, але для подолання внутрішньої хіміотерапевтичної резистентності будуть потрібні покращені терапії. Тонке механістичне розуміння націлених шляхів, що лежать в основі DLBCL із залученням ЦНС, призвело до нових таргетних агентів та імунотерапевтичних підходів, які демонструють обнадійливу клінічну активність та хороше проникнення в ЦНС.
Автор статті
MARK ROSCHEWSKI – mark.roschewski@nih.gov
Посилання та джерела
- Puckrin R, El Darsa H, Ghosh S, Peters A, Stewart DA. Lack of effectiveness of intravenous high-dose methotrexate for prevention of CNS relapse in patients with high-risk DLBCL: a retrospective analy sis from Alberta, Canada. Blood. 2020; 136(Suppl 1):26-27. https://doi.org/10.1182/blood-2020-139025|PubMed|Google Scholar
- Orellana-Noia VM, Reed DR, Sen JM. CNS prophylaxis during front-line therapy in aggressive non-Hodgkin lymphomas: realworld outcomes and practice atterns from 19 US academic nstitutions. Blood. 2020; 136(Suppl 1):27-28. https://doi.org/10.1182/blood-2020-134798|PubMed|Google Scholar
- Eyre TA, Djebbari F, Kirkwood AA, Collins GP. Efficacy of central nervous system prophylaxis with stand-alone intrathecal chemotherapy in diffuse large B-cell lymphoma patients treated with anthracycline-based chemotherapy in the rituximab era: a systematic review. Haematologica. 2020; 105(7):1914-1924. https://doi.org/10.3324/haematol.2019.229948|PubMed|PubMed Central|Google Scholar
- Eyre TA, Kirkwood AA, Wolf J. Stand-alone intrathecal central nervous system (CNS) prophylaxis provide unclear benefit in reducing CNS relapse risk in elderly DLBCL patients treated with RCHOP and is associated increased infection-related toxicity. Br J Haematol. 2019; 187(2):185-194. https://doi.org/10.1111/bjh.16070|PubMed|Google Scholar
- Cheah CY, Herbert KE, O’Rourke K. A multicentre retrospective comparison of central nervous system prophylaxis strategies among patients with high-risk diffuse large B-cell lymphoma. Br J Cancer. 2014; 111(6):1072-1079. https://doi.org/10.1038/bjc.2014.405|PubMed|PubMed Central|Google Scholar
- Schmitz R, Wright GW, Huang DW. Genetics and pathogenesis of diffuse large B-cell lymphoma. N Engl J Med. 2018; 378(15):1396-1407. https://doi.org/10.1056/NEJMoa1801445|PubMed|PubMed Central|Google Scholar
- Chapuy B, Stewart C, Dunford AJ. Molecular subtypes of diffuse large B cell lymphoma are associated with distinct pathogenic mechanisms and outcomes. Nat Med. 2018; 24(5):679-690. https://doi.org/10.1038/s41591-018-0016-8|PubMed|PubMed Central|Google Scholar
- Wright GW, Huang DW, Phelan JD. A probabilistic classification tool for genetic subtypes of diffuse large B cell lymphoma with therapeutic implications. Cancer Cell. 2020; 37(4):551-568.e14. https://doi.org/10.1016/j.ccell.2020.03.015|PubMed|Google Scholar
- Schmitz N, Zeynalova S, Nickelsen M. CNS International Prognostic Index: a risk model for CNS relapse in patients with diffuse large B-cell lymphoma treated with R-CHOP. J Clin Oncol. 2016; 34(26):3150-3156. https://doi.org/10.1200/JCO.2015.65.6520|PubMed|Google Scholar
- Klanova M, Sehn LH, Bence-Bruckler I. Integration of cell of origin into the clinical CNS International Prognostic Index improves CNS relapse prediction in DLBCL. Blood. 2019; 133(9):919-926. https://doi.org/10.1182/blood-2018-07-862862|PubMed|PubMed Central|Google Scholar
- Arvanitis CD, Ferraro GB, Jain RK. The blood-brain barrier and blood-tumour barrier in brain tumours and metastases. Nat Rev Cancer. 2020; 20(1):26-41. https://doi.org/10.1038/s41568-019-0205-x|PubMed|PubMed Central|Google Scholar
- Abramson JS, Hellmann M, Barnes JA. Intravenous methotrexate as central nervous system (CNS) prophylaxis is associated with a low risk of CNS recurrence in high-risk patients with diffuse large Bcell lymphoma. Cancer. 2010; 116(18):4283-4290. https://doi.org/10.1002/cncr.25278|PubMed|Google Scholar
- McKay P, Wilson MR, Chaganti S, Smith J, Fox CP, Cwynarski K. British Society of Haematology. The prevention of central nervous system relapse in diffuse large B-cell lymphoma: a British Society for Haematology good practice paper. Br J Haematol. 2020; 190(5):708-714. https://doi.org/10.1111/bjh.16866|PubMed|Google Scholar
- Ambady P, Holdhoff M, Bonekamp D, Wong F, Grossman SA. Late relapses in primary CNS lymphoma after complete remissions with high-dose methotrexate monotherapy. CNS Oncol. 2015; 4(6):393-398. https://doi.org/10.2217/cns.15.34|PubMed|PubMed Central|Google Scholar
- Swerdlow SH, Campo E, Pileri SA. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016; 127(20):2375-2390. https://doi.org/10.1182/blood-2016-01-643569|PubMed|PubMed Central|Google Scholar
- Ollila TA, Kurt H, Waroich J. Genomic subtypes may predict the risk of central nervous system recurrence in diffuse large B-cell lymphoma. Blood. 2021; 137(8):1120-1124. https://doi.org/10.1182/blood.2020007236|PubMed|PubMed Central|Google Scholar
- Twa DDW, Lee DG, Tan KL. Genomic predictors of central nervous system relapse in primary testicular diffuse large B-cell lymphoma (DLBCL). Blood. 2021; 137(9):1256-1259. https://doi.org/10.1182/blood.2020006338|PubMed|Google Scholar
- Lionakis MS, Dunleavy K, Roschewski M. Inhibition of B cell receptor signaling by ibrutinib in primary CNS lymphoma. Cancer Cell. 2017; 31(6):833-843. https://doi.org/10.1016/j.ccell.2017.04.012|PubMed|PubMed Central|Google Scholar
- Grommes C, Pastore A, Palaskas N. Ibrutinib unmasks critical role of Bruton tyrosine kinase in primary CNS lymphoma. Cancer Discov. 2017; 7(9):1018-1029. https://doi.org/10.1158/2159-8290.CD-17-0613|PubMed|PubMed Central|Google Scholar
- Younes A, Sehn LH, Johnson P. Randomized phase III trial of ibrutinib and rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in non-germinal center B-cell diffuse large Bcell lymphoma. J Clin Oncol. 2019; 37(15):1285-1295. https://doi.org/10.1200/JCO.18.02403|PubMed|PubMed Central|Google Scholar
- Ghesquieres H, Chevrier M, Laadhari M. Lenalidomide in combination with intravenous rituximab (REVRI) in relapsed/refractory primary CNS lymphoma or primary intraocular lymphoma: a multicenter prospective ‘proof of concept’ phase II study of the French Oculo-Cerebral Lymphoma (LOC) Network and the Lymphoma Study Association (LYSA). Ann Oncol. 2019; 30(4):621-628. https://doi.org/10.1093/annonc/mdz032|PubMed|Google Scholar
- Nowakowski GS, Hong F, Scott DW. Addition of lenalidomide to R-CHOP improves outcomes in newly diagnosed diffuse large Bcell lymphoma in a randomized phase II US Intergroup Study ECOG-ACRIN E1412. J Clin Oncol. 2021; 39(12):1329-1338. https://doi.org/10.1200/JCO.20.01375|PubMed|PubMed Central|Google Scholar